Comment Éviter une Investigation Clinique pour Votre Dispositif Médical
Introduction
Conformément au Règlement (UE) 2017/745 relatif aux dispositifs médicaux (MDR), les investigations cliniques sont en principe requises pour les dispositifs médicaux de classe III ainsi que pour les dispositifs implantables de classe IIb. Toutefois, certaines dérogations prévues par la réglementation permettent aux fabricants d’éviter la réalisation d’une investigation clinique, tout en apportant la preuve de la conformité du dispositif aux exigences générales en matière de sécurité et de performance.
Understanding these exemptions, as outlined in MDR Article 61 and guidance documents such as MDCG 2023-7, MDCG 2020-5, and MDCG 2020-6, can help streamline regulatory approval and reduce unnecessary clinical study costs.
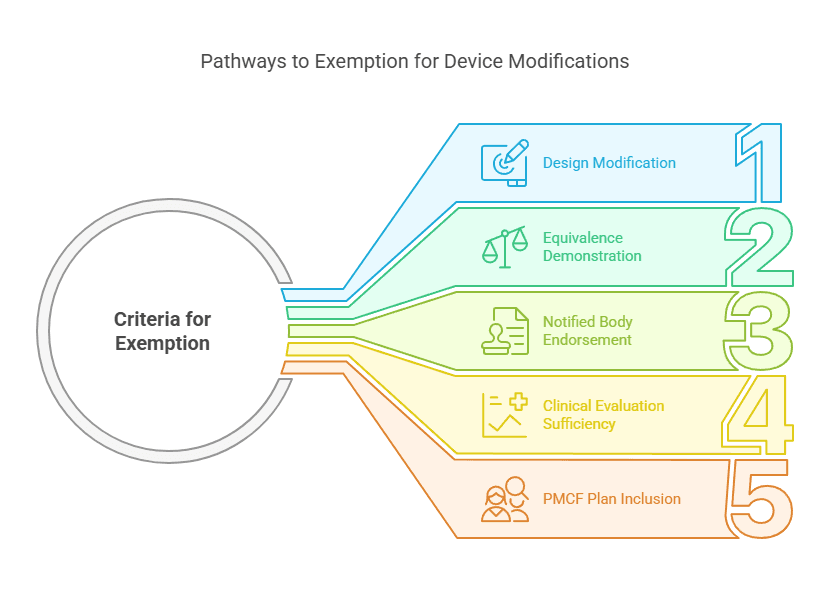
Cas n°1 : Modification d’un Dispositif déjà Commercialisé par le Même Fabricant
Lorsque le dispositif évalué (DUE) est une version modifiée d’un dispositif déjà commercialisé par le même fabricant, la réalisation d’une nouvelle investigation clinique peut ne pas être exigée.
Critères de dérogation :
Le DUE correspond à une modification de conception d’un dispositif existant du même fabricant.
L’équivalence avec le dispositif commercialisé est démontrée conformément à l’annexe XIV, section 3.
L’organisme notifié valide l’argumentaire d’équivalence.
L’évaluation clinique du dispositif déjà commercialisé est suffisante pour démontrer la conformité aux exigences générales en matière de sécurité et de performance (GSPR).
Le plan de suivi clinique après commercialisation (SCAC/PMCF) inclut des études post-commercialisation visant à vérifier la sécurité et la performance du dispositif.
Référence :
Article 61(4) du MDR, premier à troisième tirets
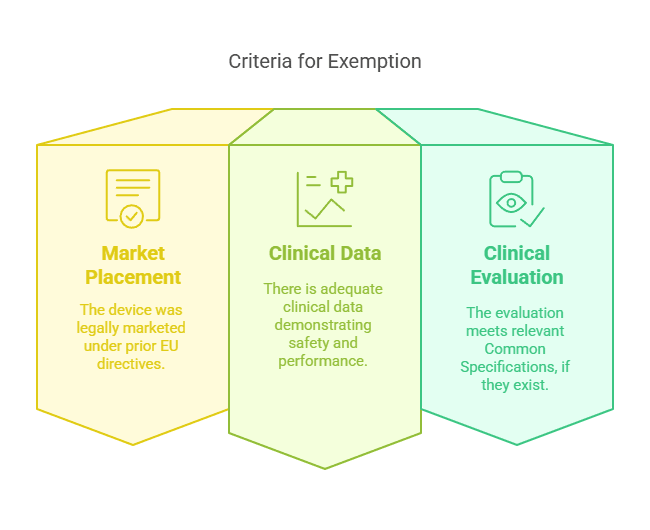
Cas n°2 : Dispositifs « Legacy » Mis sur le Marché selon les Anciennes Directives
Les dispositifs ayant été légalement mis sur le marché conformément à la directive 90/385/CEE ou à la directive 93/42/CEE avant l’entrée en application du MDR peuvent être exemptés d’investigation clinique, à condition que des données cliniques suffisantes soient disponibles.
Critères de dérogation :
Le DUE a été mis sur le marché légalement sous l’empire des anciennes directives européennes.
Des données cliniques suffisantes étayent la sécurité et la performance du dispositif.
L’évaluation clinique est conforme aux Spécifications Communes (CS) applicables, si elles existent.
Référence :
Article 61(6)(a) du MDR
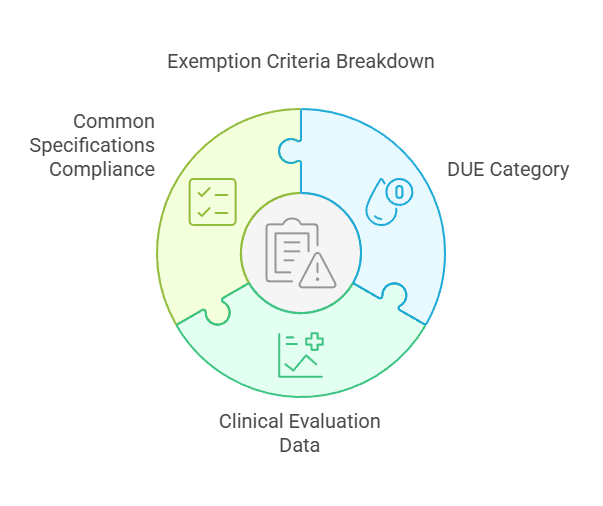
Cas n°3 : Technologie Bien Établie (WET – Well-Established Technology)
Les dispositifs relevant d’une technologie bien établie (Well-Established Technology), tels que les sutures, agrafes, vis ou obturations dentaires, peuvent être exemptés d’une investigation clinique si des données cliniques existantes sont suffisantes.
Critères de dérogation :
Le DUE appartient à la catégorie des technologies bien établies (WET).
L’évaluation clinique est étayée par des données cliniques suffisantes.
La conformité aux Spécifications Communes applicables est assurée, si elles existent.
Référence :
Article 61(6)(b) du MDR
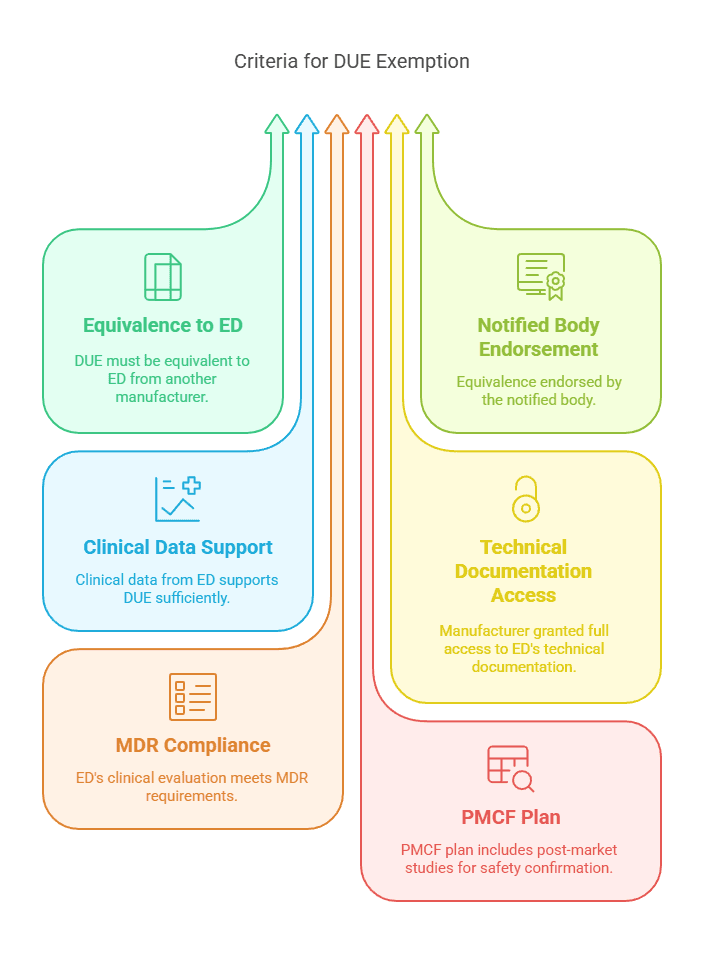
Cas n°4 : Dispositif Équivalent d’un Autre Fabricant
Un fabricant peut éviter de réaliser une investigation clinique pour un dispositif médical en démontrant l’équivalence avec un dispositif équivalent (ED) d’un autre fabricant, à condition de disposer d’un accès complet à la documentation technique de l’ED via un accord contractuel.
Critères de dérogation :
Le DUE est équivalent à un dispositif d’un autre fabricant, conformément à l’annexe XIV, section 3.
L’équivalence est validée par l’organisme notifié.
Les données cliniques issues de l’ED sont suffisantes pour étayer la sécurité et la performance du DUE.
Un contrat accorde explicitement au fabricant un accès complet à la documentation technique de l’ED.
L’évaluation clinique de l’ED est conforme aux exigences du MDR.
Le plan de suivi clinique après commercialisation (SCAC/PMCF) comprend des études post-commercialisation visant à confirmer la sécurité et la performance.
Référence :
Article 61(5) du MDR
Justification d’un Accès Suffisant aux Données
L’annexe XIV, section 3 du Règlement (UE) 2017/745 exige que les fabricants justifient leur niveau d’accès aux données cliniques, techniques et biologiques lorsqu’une équivalence est revendiquée. Toutefois, un contrat formel n’est requis que dans le cadre de l’article 61(5).
Points clés à considérer :
L’accès signifie disposer de suffisamment de données pour appuyer une revendication d’équivalence.
L’accès complet au dossier technique du dispositif équivalent (ED) est uniquement exigé dans le cadre de l’article 61(5).
Dans les autres cas de dérogation, l’accès peut être justifié par une analyse comparative, des informations disponibles publiquement ou des données cliniques internes.
Qu’en Est-il des Autres Classes de Dispositifs ?
Pour les dispositifs qui ne sont ni de classe III ni implantables, la démonstration de l’équivalence ne nécessite pas de contrat formel. Le fabricant doit néanmoins prouver qu’il dispose d’un accès approprié à des données cliniques, techniques et biologiques suffisantes, conformément à l’annexe XIV, section 3.
Points clés à considérer :
Un contrat n’est pas requis pour prouver l’équivalence des dispositifs qui ne sont pas de classe III ou implantables.
Le fabricant doit démontrer un accès suffisant aux données cliniques, techniques et biologiques.
Si les conditions nécessaires à la démonstration de l’équivalence ne sont pas remplies, une investigation clinique peut être exigée.
L’exigence de contrat prévue à l’article 61(5) s’applique uniquement à certaines situations impliquant des dispositifs de classe III ou implantables.
Conclusion
Les fabricants souhaitant éviter une investigation clinique pour leur dispositif médical doivent évaluer avec précision si leur produit entre dans l’un des quatre cas de dérogation prévus à l’article 61 du Règlement (UE) 2017/745. En exploitant intelligemment les données existantes, en démontrant l’équivalence de manière rigoureuse et en mettant en œuvre un plan solide de suivi clinique après commercialisation (SCAC/PMCF), il est possible d’atteindre la conformité réglementaire sans recourir à des études cliniques inutiles.
Points clés à retenir :
L’article 61 du MDR prévoit des dérogations précises permettant d’éviter une investigation clinique.
Une équivalence bien documentée et des données cliniques suffisantes sont indispensables.
Consulter des experts en affaires réglementaires permet de s’assurer du respect des critères de dérogation.
Recevez des Conseils Cliniques Exclusifs
Pour en savoir plus sur les stratégies d’évaluation clinique, la conformité au MDR et les parcours réglementaires, abonnez-vous à ma newsletter. Vous y trouverez des conseils exclusifs, concrets et approfondis pour optimiser vos processus d’évaluation clinique et rester compétitif dans le secteur des dispositifs médicaux :S’abonner ici





